Внедрение системы менеджмента качества
Аудит, внедрение и модернизация СМК по ISO 13485, ISO 14971, ISO 9001
В соответствии с требованиями Евразийского экономического союза (ЕАЭС) производители стерильных медицинских изделий, медицинских изделий классов риска 2б и 3 обязаны внедрить и поддерживать функционирование системы менеджмента качества (СМК) медицинских изделий в соответствии с «Требованиями к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения», утвержденными Решением Совета Евразийской экономической комиссии от 10 ноября 2017 г. N 106.
Наша компания, единственная в России, проводящая прединспеционный аудит производства МИ для подготовки к инспекции со стороны уполномоченного органа в рамках регистрации медицинских изделий по правилам ЕАЭС.
Результат:
У вас внедрена и поддерживается система менеджмента качества.
Проблем с инспектированием вашего производства возникнуть не должно!
Узнайте, как улучшить вашу СМК, консультация бесплатна!
Результат:
У вас имеются несоответствия. Советуем проанализировать ваше производство перед приемом инспектирующей организацией!
Обратитесь, мы проконсультируем вас абсолютно бесплатно!
Результат:
У вас критические несоответствия. Сомневаемся, что вам удастся успешно пройти инспектирование. Советуем вам обратиться за помощью в нашу компанию!
Консультация бесплатна, обратитесь прямо сейчас!
Эксперты в области систем менеджмента и инспекторы производства компании ФРОНИКА ГРУПП провели анализ требований Решения Совета Евразийской экономической комиссии от 10 ноября 2017 г. № 106 “О Требованиях к внедрению, поддержанию и оценке системы менеджмента качества медицинских изделий в зависимости от потенциального риска их применения”. В основе решения № 106 лежит стандарт ISO 13485 и подходы системы MDSAP (программа аудита производителей медицинских изделий). Единственное различие состоит в том, что акцент в требованиях СМК решения № 106 сделан на оценке соответствия изделий требованиям безопасности, установленным Решением коллегии ЕЭК № 27. Подразумевается переход от контроля конечного изделия к контролю условий его производства и системы менеджмента качества действующей на нем как наиболее эффективный способ значительного повышения качества обращаемых на рынке медицинских изделий.
В отдельной публикации приводим подробную информацию, которая поможет производителям лучше подготовиться к инспектированию.
 Наш специалист - в реестре экспертов Росздравнадзора,
Наш специалист - в реестре экспертов Росздравнадзора,
осуществляющих лицензионный котроль при производстве мед. изделий и котроль за обращением мед. изделий.
Внедрение и модернизация СМК в соответствии с требованиями ГОСТ ISO 13485, ГОСТ ISO 14971, ГОСТ ISO 9001
- Разработка программы внедрения СМК
- Идентификация процессов, разработка критериев и методов оценки их результативности и схемы взаимосвязи процессов
- Разработка матрицы ответственности
- Формирование структуры документов
- Разработка, экспертиза документов СМК
- Подготовка СМК
Подготовка к сертификации СМК
- Аудит СМК предсертификационный
- Выбор органа по сертификации
- Оформление и подача заявки на сертификацию СМК в орган по сертификации
Аудит системы менеджмента качества
- Оценка системы менеджмента качества при производстве медицинских изделий
Поддержание и улучшение СМК
В сложившихся условиях жесткой конкуренции на рынке медицинских изделий, внедрение системы менеджмента качества (СМК) медицинских изделий у производителя, особенно в соответствии со специализированным стандартом ГОСТ ISO 13485 «Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования», является значительным конкурентным преимуществом, указывающим на стремление производителя осуществлять производство медицинских изделий в контролируемых условиях, с соблюдением всех применимых требований и учетом требований потребителей.
Описание и оптимизация существующих бизнес-процессов
- Сокращение затрат на производство медицинских изделий за счет более эффективного распределения внутренних ресурсов, четкого распределения ответственности и полномочий сотрудников
- Грамотное выстраивание бизнес-процессов компании от производства продукции до организации работы сети поставок
- Возможность выхода на международные рынки
Организация специализированных обучающих семинаров по СМК
Организация специализированных обучающих семинаров
В компании Fronika group работают только дипломированные инспекторы производства
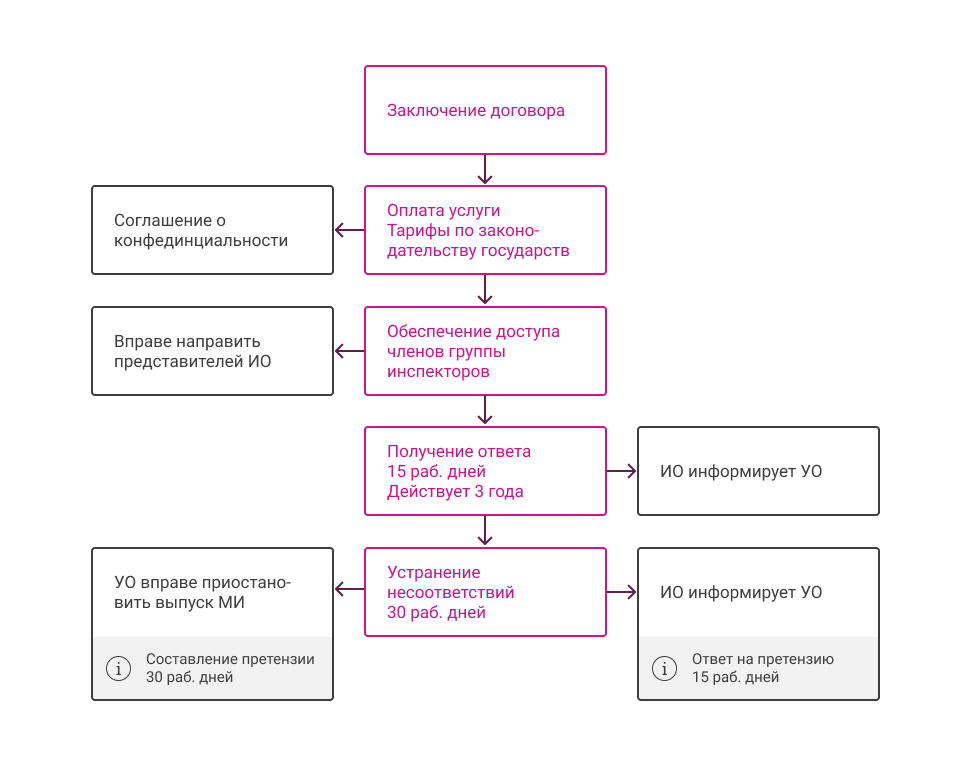
Схема инспектирования по решению 106
Что такое система менеджмента качества
Система менеджмента качества — это комплекс систем, методов и инструментов, которые компания использует, чтобы удовлетворять требования потребителей и предвосхищать их ожидания относительно продукции/услуги, повышать свою конкурентоспособность и конкурентоспособность конкретной продукции/услуги, совершенствовать деятельность компании в целом.
Цель СМК состоит не в контроле каждой единицы продукции/услуги, а в исключении возможных ошибок в работе, из-за которых может возникнуть дефект или брак. Для этого нужно определить, какие действия являются правильными для создания качественной продукции/услуги, разработать инструкцию по осуществлению действий, контролировать, анализировать и оценивать их. Требования к СМК сформулированы в международных стандартах ISO 9000, а основные положения — стандарте ГОСТ Р ИСО 9001.
Внедрение СМК объективная необходимость для организации, делающей ставку на повышение конкурентоспособности и постоянное улучшение качества продукции или услуг. СМК подразумевает охват основных процессов планирования, организации, выполнения, контроля и анализа деятельности компании:
- технологии управления;
- карт бизнес-процессов;
- реестра нормативной документации (перечня регламентов);
- регламентов, стандартов компании, документальных процедур;
- утвержденных показателей самих процессов;
- локальной нормативной документации по персоналу (аттестация персонала, а также системы мотивации, бонусы, лояльность);
- схемы управления документированной информацией;
- форм документации.
Идеология СМК базируется на восьми принципах менеджмента качества:
- Ориентация на потребителя — понимание требований потребителей, соответствие их требованиям и возможность превзойти их ожидания.
- Лидирующая роль руководства — создание единых целей и направлений деятельности компании.
- Вовлечение персонала — раскрытие и использование способностей работников с пользой для компании.
- Процессный подход — деятельность компании воспринимается как совокупность процессов.
- Системный подход к менеджменту — позволяет фокусировать усилия на ключевых процессах, интегрировать и выстраивать в цепочку те процессы, которые лучшим образом позволят достичь желаемых результатов.
- Постоянное улучшение деятельности компании.
- Принятие решений на основе фактов — принятие решений основывается на анализе данных и информации.
- Взаимовыгодные отношения с поставщиками
Систематическая идентификация и менеджмент применяемых в компании процессов, и особенно их взаимодействия, могут считаться процессным подходом. Основная цель процессного подхода заключается в улучшении результативности и эффективности компании в достижении поставленных целей.
В основе концепции процессного похода в менеджменте лежат:
- Принципы построения СМК по стандартам ИСО 9000.
- Цикл Деминга («цикл Шухарта — Деминга») PDCA (Plan-Do-Check-Action).
- Принципы построения BSC (Balanced Scoreсard, система сбалансированных показателей), разработанной американцами Дэвидом П. Нортоном (David P. Norton, р. 1941) и Робертом С. Капланом (Robert S. Kaplan, р. 1940).
- Принципы управления проектами, так как любые изменения в компаниях, в том числе и внедрение процессного подхода, выполняются как проект.
- Лучший мировой опыт в области построения СМК.
Выделяют три основных группы процессов:
- Сквозные (межфункциональные), которые проходят через несколько структурных подразделений компании или через всю компанию, пересекающие границы функциональных подразделений;
- Процессы (внутрифункциональные) и подпроцессы структурных подразделений, деятельность которых ограничена рамками одного функционального подразделения компании;
- Операции (функции) самого нижнего уровня декомпозиции деятельности компании (как правило, выполняются одним человеком).
Обзор стандарта ISO13485
Основой этого стандарта являются общие требования к системам менеджмента качества, которые устанавливает стандарт ISO9001. ISO13485 использует основу ISO9001, добавляя медицинские термины и определения для конкретного применения в медицинской отрасли.
От качества медицинских изделий зависит жизнь человека, тем самым растущая потребность в качественном оборудовании заставляет задуматься о конкурентоспособности организации.
На данный момент существует следующие сопутствующие стандарты:
- ISO13485:2016 (ГОСТ ISO 13485-2017) «Изделия медицинские. Система менеджмента качества. Системные требования для целей регулирования»;
- ISO/TR14969:2004 (ГОСТ Р ИСО/ТО 14969 – 2007) «Изделия медицинские. Системы менеджмента качества. Руководство по применению ИСО 13485:2003»;
- ISO 14971:2007 (ГОСТ ISO 14971-2011) «Изделия медицинские. Применение менеджмента риска к медицинским изделиям». Стандарт по менеджменту рисков, изначально предназначенный для медицинских изделий.
Требования стандарта делятся на следующие группы:
- Требования к системе менеджмента качества общего характера
- Ответственность руководства
- Управление ресурсами
- Менеджмент процессами всего жизненного цикла продукции
- Анализ, измерения, улучшения
- Принципы ISO13485 базируются на 8 принципах системного управления качеством, близким к идеологии Всеобщего управления качеством (TQM - Total Quality Management)
Внедренная и сертифицированная система менеджмента качества медицинских изделий позволяет:
- Подтвердить качество выпускаемой продукции соответствием требованиям международного стандарта;
- Повысить производительность и эффективность использования ресурсов;
- Уменьшить количества рекламаций;
- Повысить имидж компании.












